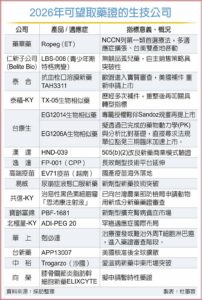
資料來源:2025-08-26 / 工商時報 杜蕙蓉
逸達(6576)26日公告,旗下治療前列腺癌新劑型新藥CAMCEVI 三個月劑型,通過美國FDA上市審查,由於後續還須取得J-Code等流程,預期正式上市並貢獻營收會落在今年底。該藥由授權夥伴Intas 美國子公司Accord 負責市場銷售。而逸達在取證與藥品正式上市時,都有機會取得里程碑金,未來並有銷售分潤。
逸達的CAMCEVI六個月劑型,已獲美、加、歐洲、台灣、以色列、英國等國藥證核准,並已於2022年4月及2025年分別於美國、德國和加拿大正式上市,初估該藥已取得美國約15%的市佔率。
不過,因用藥習慣,三個月劑型仍是市場主流,其市場規模是六個月劑型的2倍以上,因此,受惠三個月劑型到手,將可加速該產品的市占增長與回收,助力逸達業績大幅成長。營運漸入佳境的逸達,前七月營收2.31億元,較去年同期略減1.19%;上半年每股淨損4.04元。
除了美國市場藥證報捷外,中國大陸授權夥伴長春金賽藥業,則是繼今年2月8日完成向大陸藥監局(NMPA)遞交上市許 可申請後,月前也向新加坡健康科學局(Health Science Authority, HSA),提交前列腺癌新劑型新藥CAMCEVI 42毫克(六個月劑型)上市申請。
根據全球癌症資料庫GLOBOCAN統計,前列腺癌是全球男性第二大常見的癌症,2022 年全球男性約一千萬個癌症新例中,有14.2%是罹患前列腺癌。
另根據Nova One Advisor 統計,2022年全球前列腺癌藥物市場(prostate cancer therapeutics)約164.6億美元,預估2032年全球前列腺癌藥物的市場將成長至365.4億美元,預估複合年增長率為8.3 %,與CAMCEVI相關之荷爾蒙療法的市場亦相當可觀。
(首圖來源:財訊週刊)
全文網址:https://www.ctee.com.tw/news/20250826701119-430504