距離報名截止還剩下:
臨床試驗(Clinical trial)是新藥從研發階段通往商業化的必經之路,上市前需要先在人體內驗證其安全性及有效性,過程中牽涉到嚴謹的法規及倫理規範,唯有依賴多方團隊的協力合作下,才能順利推動新藥開發進展。
想要進入臨床試驗產業,需要具備相對應的基礎生醫背景知識,才能了解其工作內容的深意,相對的也更容易被接納。我們可以觀察到,臨床試驗從業人員多是從醫學院或生科等相關系所畢業出來的專業人士。
零經驗的新鮮人如何能快速累積對臨床試驗產業的認知?透過這堂初階概論課程,妥善利用晚上閒暇的時間,4天8小時跟隨國際CRO公司臨床試驗經理的步伐,循序漸進走過以下四大面向:臨床試驗產業環境、各團隊角色組成及分工、ICH法規依據和試驗執行流程。
根據前四屆學員的回饋,課後對臨床試驗的認識更具體了。在分工非常細的臨床試驗產業內,找到自己感興趣或不想從事的職位,對未來的工作模式及內容有更深入的了解,提供他們除了走學術研究之外的另一種職涯可能性。
關於課程
主辦單位:台灣光鹽生物科技學苑
課程地點:線上同步遠距教學 (Microsoft Teams Live Webinar)
【本線上課程未獲得講師授權,故無提供錄影檔,敬請見諒】
課程時間:115年1月20日 (二) 至1月23日 (五) 19:30至21:30 (19:00開放線上直播測試報到)
授課師資:江君敏 國際CRO公司臨床試驗經理🔎
授課內容
| 章節 | 內容 |
|---|---|
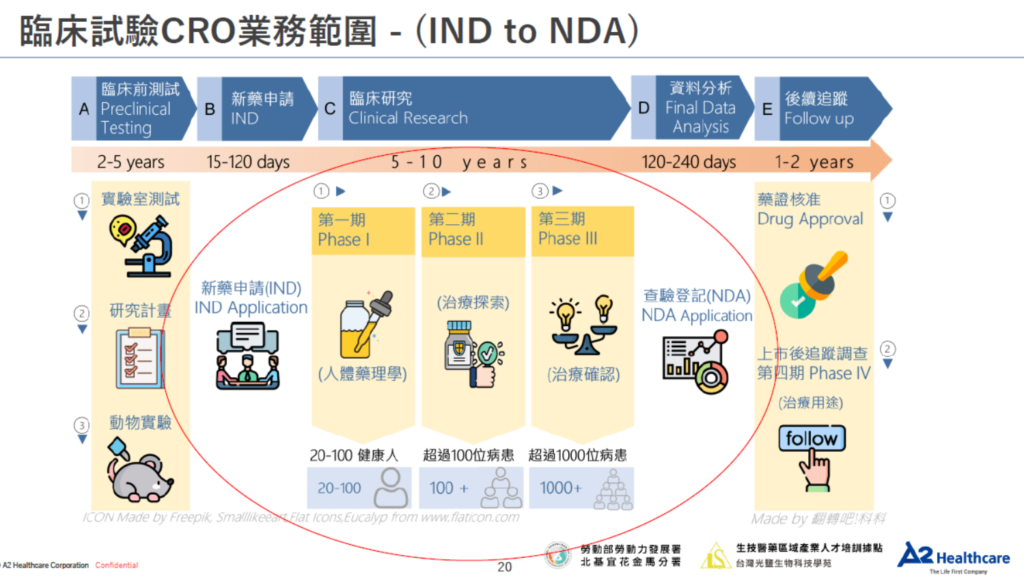
| 115/1/20 (二) 19:30至21:30 一、新藥開發、試驗概論與法規基礎 Drug Development, Trial Overview, and Regulatory Foundation | 主題:新藥開發歷程、臨床試驗概論與 ICH-GCP 基礎 (Introduction to Drug Development, Clinical Trials & ICH-GCP Foundation) A. 新藥開發:新藥開發及臨床試驗簡介 (Drug Development and Clinical Trial Overview) 1. 新藥開發階段與里程碑 (IND, NDA) 2. 臨床試驗階段與目標 (Phases I-IV introduction) 3. 臨床試驗設計基本要素 (Trial design basic elements) B. 法規基礎:優良臨床試驗規範 (GCP) 核心原則 (Core Principles of Good Clinical Practice (GCP)) 1. 受試者保護與知情同意 (Subject protection & Informed consent/consenting) 2. 品質保證系統與規範文件 (Quality assurance system and Essential Documents) 3. 國際協和會指引概覽 (ICH guidelines overview) C. 總結:學習確認與名詞解釋 (Learning Check and Terminology Review) |
| 115/1/21 (三) 19:30至21:30 二、試驗機構與執行角色 Clinical Trial Site and Roles of Trial Conduct | 主題:臨床試驗機構的組織架構與參與角色 (Organizational Structure and Key Roles at the Clinical Trial Site) A. 機構職責:試驗機構組織架構及運作 (Site’s Responsibilities: Organizational Structure of the Clinical Trial Site) 1. 試驗主持人的職責 (PI/Sub-I responsibilities) 2. 試驗機構內品質管理系統 (Institution quality management system) B. 獨立監督:人體試驗倫理委員會 (IRB/EC) 職責 (Responsibility of Institutional Review Board (IRB/EC)) 1. 倫理委員會的組成與功能 (Composition and role of function) 2. 送審、審查與持續審核流程 (Procedures of submission, review, and continuation review) C. 總結:學習確認與倫理案例分享 (Learning Check and Ethics Case Sharing) |
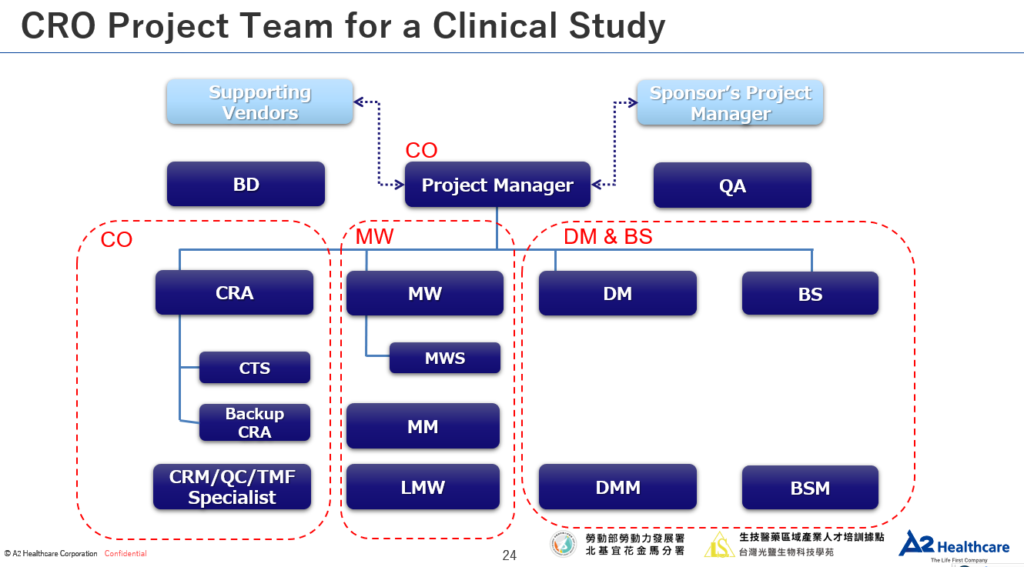
| 115/1/22 (四) 19:30至21:30 四、委託者/受託研究機構專業分工與法規體系 (Sponsor/CRO Professional Roles and Regulatory System) | 主題:委託者/受託研究機構的組織架構、專業角色與法規依據 (Sponsor/CRO Organizational Structure, Professional Roles, and Regulatory Basis) A. 委託者/CRO:委託者/受託研究機構的角色與分工 (Role and job description for Sponsor/CRO) 1. 臨床運營與監管 (Clinical Operations & Monitoring) 2. 藥物警戒與安全性報告 (PV & Safety Reporting) 3. 臨床資料科學與生物統計 (Data Science & Biostatistics) 4. 法規事務、醫藥事務與寫作 (Regulatory, Medical Affairs & Writing) B. 法規體系:ICH-E 系列指引的應用 (Application of ICH E-Series Guidelines) 1. 試驗報告撰寫 (E3) 與統計考量 (E9) 2. 藥物安全資料管理 (E2A-E2F) C. 總結:學習確認與專業發展路徑 (Learning Check and Career Pathway) |
| 115/1/23 (五) 19:30至21:30 四、試驗生命週期與品質風險管理 (Trial Life Cycle and Quality Risk Management) | 主題:臨床試驗生命週期及品質風險管理 (Clinical Trial Life Cycle and Quality Risk Management) A. 試驗流程:臨床試驗生命週期主要活動 (Key Activities in the Clinical Trial Life Cycle) 1. 試驗規劃:可行性評估與試驗計畫設計、試驗機構篩選 (Trial Planning: Feasibility, protocol design, site selection) 2. 起始流程與試驗機構啟動:送審、起始會議 (SIV)、 試驗機構啟動 (Start Up processes & Site Activation: IRB/EC & Regulatory submission, SIV, Site Activation) 3. 試驗執行:受試者招募、訪視與監測/風險導向監測 (Trial Conduct: Recruitment/Retention, monitoring/Risk-based monitoring) 4. 結案:結案訪視與資料歸檔 (Trial Close-out: site close-out and document archival Activities) B. 品質管理:臨床試驗品質與風險管理 (ICH-E6 R3) (Trial Quality Management: Clinical trial quality and risk Management (ICH-E6 R3)) 1. 品質管理系統 (QMS) 與試驗稽核/查核 2. 臨床試驗中的風險評估與對應措施簡介 C. 總結:學習確認與未來趨勢 (如去中心化試驗) (Learning Check and Future Trends (e.g., Decentralized Trials)) |
課程收費&報名連結
| 一般報名 | |
|---|---|
| 單堂 | 系列課程(共4堂) |
| 1,000元 | 2,800元 |
* 本課程為完整系列課程,需四天全程參與 (共8小時),並完成課前/課後測驗,使得核發本線上課程結業證書
* 由於線上課程核發之電子證書需設防偽標記及建立專屬識別碼,因此將於課後兩週內連同發票寄送至您的電子信箱
歷屆學員回饋
第一屆學員心得(2020/12/7~12/11)
第二屆學員心得(2021/2/1~2/5)
第三屆學員心得(2021/4/26~4/29)
第四屆學員心得(2025/2/17~2/20)
課程特色
講師介紹
江君敏
主要經歷:
- 華鼎生技顧問股份有限公司 臨床研究品管經理
- 台灣雙健維康生技顧問有限公司 品保部經理
- 健永生技股份有限公司 臨床專案經理
- 美捷國際有限公司 資深臨床研究專員
- 科文斯諮詢服務股份有限公司 資深臨床研究專員
- 台灣中外製藥股份有限公司 臨床研究專員
- 佳生科技顧問股份有限公司 臨床營運經理
相關文章
你可能感興趣?
FAQ
一、如何報名課程?
- 填寫並送出Google報名表單。
- 進入線上繳費系統完成繳費。
- 以上步驟全數完成才視為成功報名。
二、找不到繳費連結怎麼辦?
繳費連結會出現在『報名表單送出界面』。
如果你不小心關閉報名完成頁面,或是事後才想繳費,最後卻找不到繳費連結,以下提供您幾個方式:
- 重新填寫並送出報名表單,再次獲取繳費連結。
- (建議)來信學苑bioschool@biotech-edu.com索取繳費連結。
最好的方式當然是報名+繳費動作一次完成,以防時間過太久忘記繳費而錯過報名期限。
三、公司報帳要注意些什麼?
如您需報帳,可直接於線上繳費系統中輸入公司正確統編,或您可來信學苑告知。(凡發票打抬頭統編者,視為單位/公司付費派訓,結訓證書將署名「xxx單位/公司(統編公司)及學員姓名」,敬請學員自行評估,謝謝。
**特別提醒:如您需開立公司統編及抬頭,請於開課前告知,恕不接受課後進行任何形式的異動。(如有此類異動需求,也請於課前告知並說明原因。)
四、公司報名無法於線上繳費系統作業,是否有提供其他繳費管道?
公司報名作業,如無法於本繳費系統作業者,請來信或來電本學苑洽詢。我們會提供您學苑的銀行帳號,屆時再將費用匯至該帳號,並回信告知轉出帳號末五碼,如需打統編抬頭則可一併告知,使完成報名手續。
五、如何確認有報名成功?
您會在完成繳費後數個工作日內,收到由光鹽寄出的<報名成功通知信件>,收件信箱為您報名時填寫之Email。如遲遲未收到請先至『垃圾郵件』內查找,或可聯繫學苑詢問課程通知進度。
六、報名後何時可以拿到發票及證書?
如為實體課程,發票及證書將於開課日當天發放。請在離開課程會場前,確認姓名、公司抬頭統編是否正確。
如為線上課程,電子發票將於課程結束後寄送至您報名時所留的email,請於報名時確認email正確無誤。(線上課程核發之電子證書需設防偽標記及建立專屬識別碼,程序較為複雜,如有不便煩請見諒)
如您急需開立電子發票或證書,請來信或致電學苑告知原因,我們將協助加快審查程序。
七、如果還有更多問題該怎麼辦?
歡迎於上班時間 : 週一 ~ 週五 09:00 – 18:00
透過以下方式聯繫學苑
- 來信學苑信箱 bioschool@biotech-edu.com
- 致電聯繫專人客服電話 02-2545-9721
- 透過官網「聯絡我們」功能