一、各組織執行臨床試驗的相互關係
臨床試驗最主要的目的有2點:確保受試者安全、確保所收集到的資料是正確且可靠的,所以為維護整個試驗進程是流暢且受監控的,當中參與的組織非常多,而CRO公司在當中扮演串接各組織的靈魂角色。
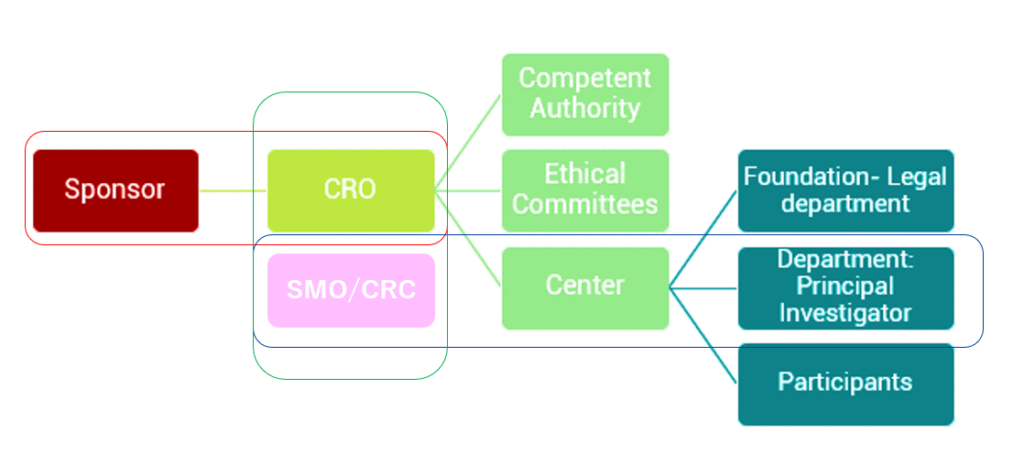
1. Sponsor-CRO:Sponsor(甲方)委託CRO公司(乙方)執行臨床試驗。
2. CRO-SMO/CRC:CRO公司與SMO或醫院臨床研究中心的護士(CRC)合作執行臨床試驗。
3. CRO-Competent Authority / Ethical Committees / Center:
- CRO執行臨床試驗案前需要通過主管機關(TFDA)、倫理委員會(IRB)、醫院(Site)審查。
- 醫院內的組織又包含:Foundation(基金會管理臨床試驗合約)、Principle Investigator(醫生通常會擔任試驗主持人,簡稱PI)、Participants(受試者參與試驗並提供臨床數據)。
延伸閱讀:
What is a CRO and how can it help you in your clinical trial
CRO vs Sponsor Challenges – Modis Life Sciences
入行CRO:對行業型態與職務發展的認識- 暘氏手札 – Yang-Notes
二、臨床試驗CRO公司內的組織架構
以一個較全面的臨床試驗CRO公司而言,可以處理的臨床試驗案子的範圍包含:前期的IND新藥申請(彙整臨床前試驗數據+試驗計劃書撰寫)到Phase IV PMS上市後追踪調查(副作用/不良反應資料收集與分析)。可想而知,臨床試驗CRO公司內部會根據不同的職務內容分派不同功能的人來負責,主要分成以下5大部分:
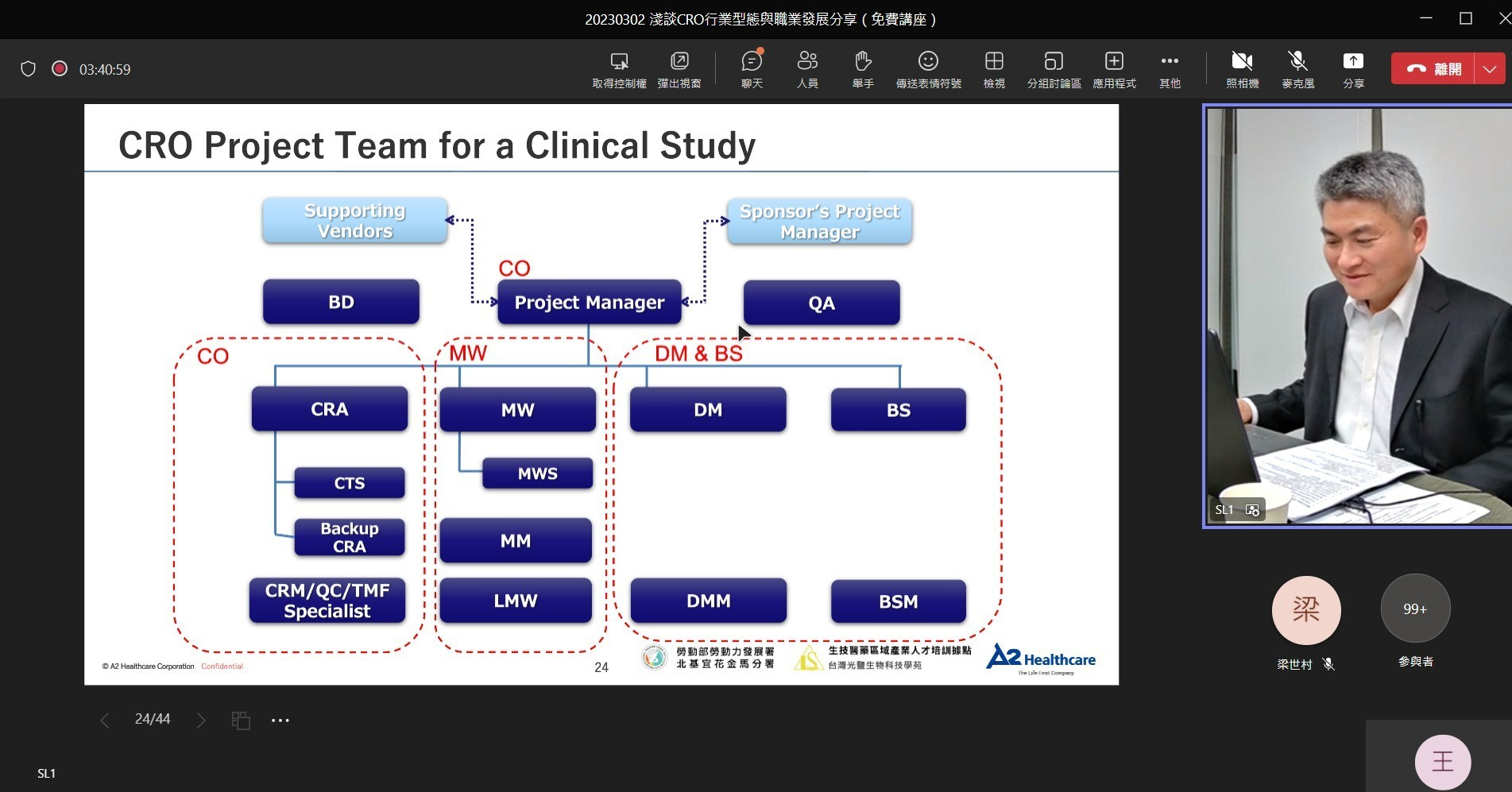
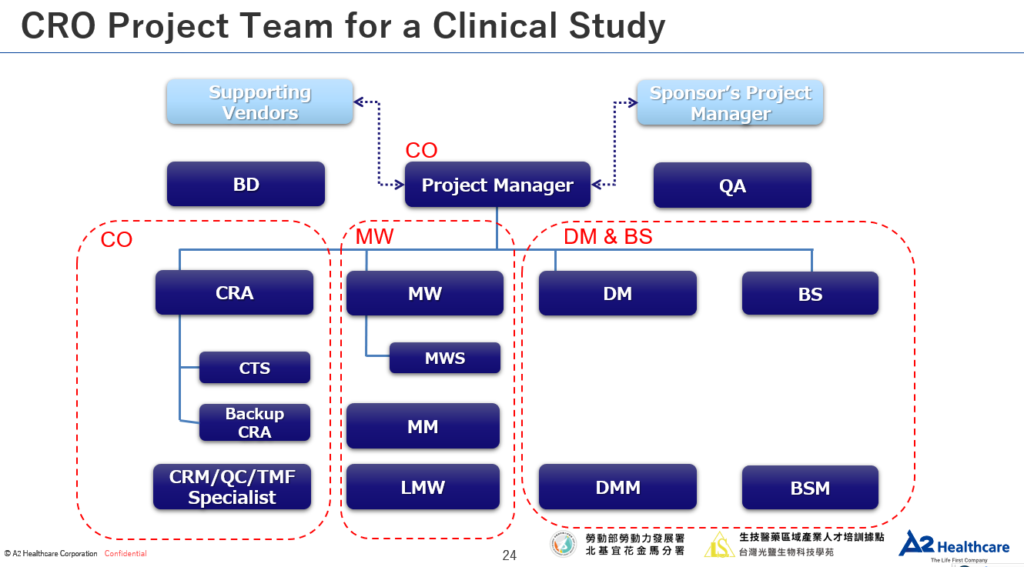
1. Clinical Operation(CO)臨床試驗部門:
- 專案經理(Project Manager,PM):執行臨床試驗的核心人物,負責掌管整個臨床試驗案的進度與預算、擔任Sponsor與Site端之間的溝通橋樑等工作。
- 臨床試驗專員(Clinical Research Associate,CRA):負責臨床試驗執行院所(Site)的管理,包含協調並監測PI及CRC是否有確實按照Protocol執行試驗、管理試驗藥品等工作。
- 臨床試驗助理(Clinical Trial Specialist / Assistant,CTS / CTA):負責所有CRA在on-site以外的事務,主要會base在公司內處理送審相關的業務。
通常在臨床試驗CRO公司內部的職業發展路徑是從CTS做起,在公司內先熟悉送審業務。之後就能升級成CRA進Site端監測試驗執行。最後了解所有試驗流程後,擔任PM掌控大局。
延伸閱讀:
TFDA推出【藥品臨床研究專員(CRA)職能訓練指引】,未來擔任CRA有資格認定!
職缺白話文-臨床試驗 送審職缺
臨床試驗專員(CRA)起步階段的經歷與感想(Entry Level)
臨床研究職涯的下一步:區域臨床試驗專員長(RLCRA) – Novotech CRO
2. Medical Writing(MW)醫學寫作部門:
- 醫藥學術專員(Medical Writer,MW):運用醫學科學知識與精準的英文寫作能力讓在不同國家執行的臨床試驗得以順暢地溝通與進行。工作內容包含臨床試驗相關檔案的撰寫,例如:臨床試驗計劃書(Protocol)、知情同意書(ICF)、臨床試驗報告(CSR)撰寫等。
- 藥物安全監視專員(Medical Monitor / PharmacoVigilance Specialist,MM / PVS):通常由醫生擔任,負責不良事件的監測與通報等工作。
MW部門由於需要頻繁與醫生溝通、撰寫專業文件,所以組成人員通常具有博士學歷,且對於英語能力也相對有要求,畢竟臨床試驗所需文件及相關文獻資料都是以英文為主。
延伸閱讀:
Medical Writer必備技能:不良事件編碼及MedDRA簡介
臨床試驗計畫書應載明哪些事項?- 財團法人醫藥品查驗中心
3. Data Management & Biostatistics(DM & BS)資料處理與統計部門:
- 資料管理專員(Clinical Data Manager,CDM):透過程式語言的幫助將臨床試驗過程所產生的資料整理成具有邏輯正確且具統計意義的資料,最後歸檔進資料庫中。
- 生物統計師(Biostatistician,BS):參與試驗設計、樣本數估算、後續的試驗數據分析等工作。
一般而言,除了在MW部門博士具有優勢外,另一個地方就是BS,需要博士專業的統計師,分析臨床試驗數據最終產出報告,數據取得的方式設計與取得後分析的正確性攸關整個臨床試驗案的成敗。
4. Quality Assurance(QA)品質保證專員:
- 監督整個臨床試驗執行過程有沒有遵守GCP規範、文件歸檔有沒有符合要求等工作。
延伸閱讀:
ICH GCP導讀與實例解說
Efficacy Guidelines – ICH
Search for FDA Guidance Documents
5. Bussiness Development(BD)事業發展專員:
- 主要擔任公司對外的業務窗口,後續接進來的案子才轉交到CPM做執行。
三、臨床試驗CRO公司內部各職務的專業分工
1. Clinical Operation(CO)臨床試驗部門:
| 負責人員 | 職務內容 |
|---|---|
| PM | Clinical Project Management 臨床試驗專案管理 |
| Site Feasibility Study 試驗機構可行性調查 | |
| Investigator Selection 試驗主持人篩選 | |
| SSU(Study Start-Up team) | Regulatory Authorities Submission 主管機關法規單位送審 |
| IRB/IEC Submission 人體試驗委員會送審 | |
| Informed Consent Form Generating 知情同意書擬定 | |
| CRA | IRB and Authorities Interim Report Submission 期中報告(IRB和主管機關送審) |
| Site Management 試驗機構管理 | |
| Monitoring Activities 臨床試驗活動監測 | |
| CRA / PM | Clinical Supplemental Handling 試驗藥品、針筒等試驗所需物品的管理 |
| CRA / PVS | Adverse Event Reporting 不良事件監測及呈報 |
推薦課程:
【31小時CRA系列課程】最適合無相關工作經驗的新鮮人,面試CRO籌碼+1
臨床試驗專員CRA初階實務培訓班(預約報名)
臨床試驗專案管理人員CPM初階實務培訓班(預約報名)
從執行角度看臨床試驗設計的問題及注意事項(預約報名)
如何加速臨床試驗收案進度~收案策略、困境與管理~(預約報名)
2. Medical Writing(MW)醫學寫作部門:
| 負責人員 | 職務內容 |
|---|---|
| MW | Clinical Protocol Writing 臨床試驗計劃書撰寫 |
| Clinical Study Report Writing 臨床試驗報告撰寫 | |
| Clinical Investigator’s Brochure Writing 臨床試驗主持人手冊撰寫 | |
| eCTD preparing and submission for IND and NDA 新藥臨床試驗申請與查驗登記所需eCTD文件準備 | |
| Special Science Report Writing 客戶所交辦的研究報告撰寫 | |
| Medical Coding 不良事件編碼 MedDRA | |
| MM / MD | Medical Monitoring 醫學檢測 |
| PVS | PV management 藥物安全管理 |
推薦課程:
醫藥學術專員(Medical Writer)培訓初階班(預約報名)
醫藥學術專員(MSL)初階實務培訓班(預約報名)
國際查驗登記CTD撰寫技巧與案例解析(預約報名)
3. Data Management & Biostatistics(DM & BS)資料處理與統計部門:
| 負責人員 | 職務內容 |
|---|---|
| CDM | Case Report Form Design 個案報告表設計 |
| Clinical Data Management 臨床試驗資料處理 | |
| Database Creating and Maintaining 資料庫建立及管理 | |
| BS | Study Design and Sample Size Estimation 試驗設計與樣本數估算 |
| Biostatistical Analysis Plan / Report Writing 生物統計分析計畫撰寫 | |
| Biostatistical Analysis 生物統計數據分析 |
4. Quality Assurance(QA)品質保證專員:
| 負責人員 | 職務內容 |
|---|---|
| QA | SOP management 標準作業程序管理 |
| GCP Auditing 藥品優良臨床試驗規範查核 | |
| Double blind labeling monitoring 雙盲試驗標籤監測 | |
| Unblind Monitoring 解盲監測 | |
| Essential documents QA 臨床試驗文件品管查核 |
推薦課程:
臨床試驗品質管理與實務
藥廠品管人員初階培訓班(預約課程)