國內外生技藥廠動態
國內外生技藥廠動態
藥華藥(6446)血癌新藥解盲達標!藥華藥4日發布重大訊息,說明公司P1101之原發性血小板過多症(ET)第三期臨床試驗主要評估指標的統計結果正面,P值為0.0001,達到統計上顯著意義。藥華藥表示,P1101在美國市場係由藥華藥自建團隊負責行銷及銷售,未來可運用現有銷售團隊和通路迅速進入ET市場,成為藥華藥衝刺業績成長又一強大動能。...
聖安生醫(6926)30日宣布,自主研發的全球創新抗癌新藥,SOA101 奈米三特異性T細胞銜接抗體,向TFDA申請在台灣進行臨床一/二期a試驗;該新藥上周也獲美國FDA同意執行臨床。...
共信(6617)25日宣布,旗下PTS癌症新藥在2023年取得中國藥證後,為擴大適應症,將與馬偕醫院攜手執行口腔鱗狀上皮細胞癌人體臨床試驗。...
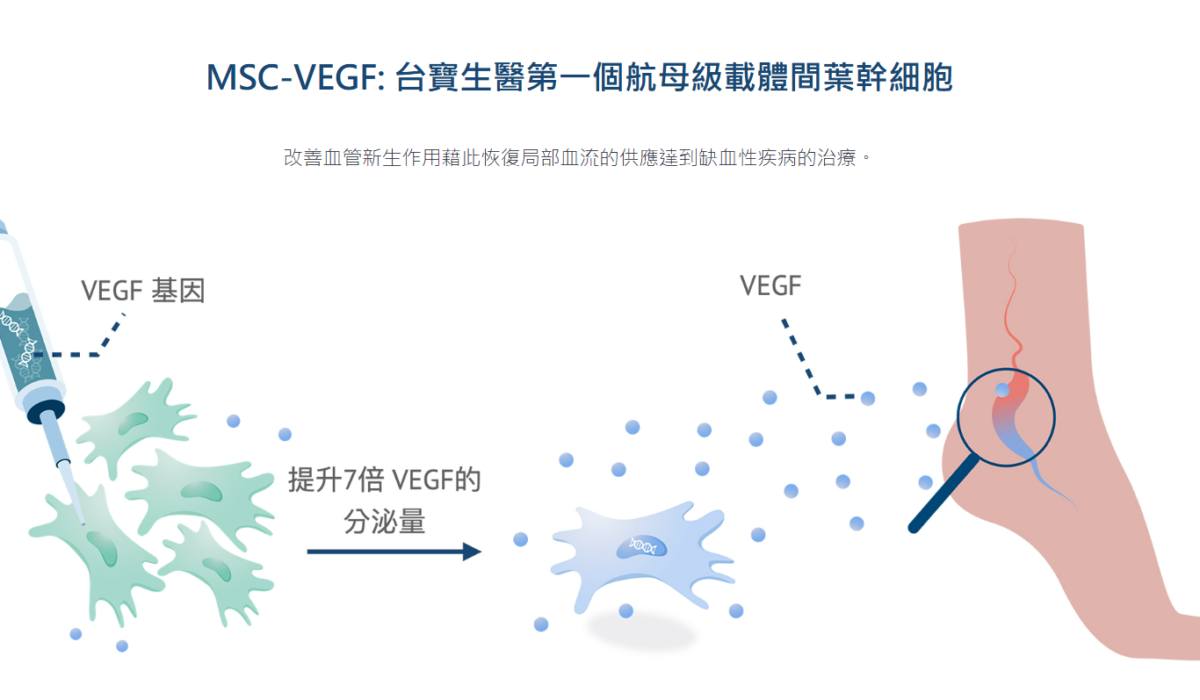
台寶生醫(6892)22日公告,治療危急性肢體缺血異體細胞新藥MSC/VEGF,已向美國食品藥物管理局(FDA)提交人體臨床試驗審查(IND)申請,成為全球第一個瞄準嚴重慢性疾病的異體基因修飾細胞治療新藥。...
台灣醣聯(4168)17日宣布,攜手日本三菱瓦斯化學株式會社(MGC)開發治療骨質疏鬆症的Denosumab生物相似藥SPD8,已完成三期臨床試驗的首例收案,預計2026年第二季解盲。SPD8將委由台康生技(6589)生產,合作布局日本及國際市場。...
昱展(6785)14日宣布,自行研發的Ketamine (氯胺酮)緩釋注射劑ALA-3000通過美國FDA新藥臨床試驗(IND)申請審查,核准執行於難治型憂鬱症(Treatment-resistant depression, TRD)的臨床I/IIa期試驗。...
讀者專欄
在生技製藥領域內,法規人員(Regulatory Affairs,RA)的職務內容會因應公司產業、產品類別或產品正處於的生命週期而有所差異,但終極目標不會改變:確保醫藥產品合規並達成預期所訂定的目標,如IND、NDA或產品上市等目的。...
藥廠法規人員(Regulatory Affairs,RA)不僅是藥廠與衛生主管機關之間的溝通橋樑,更是推動藥品從研發到上市,乃至後續許可證維護的重要推手。透過對藥品查驗登記等法規制度的深入理解,RA 協助藥廠進行產品的生命週期管理,確保每一步皆符合各國監管機構的法規要求,進而保障民眾的用藥安全與公共健康。...
隨著細胞治療技術的快速發展,許多再生醫療業者面臨如何將此新興生醫技術成功商業化的挑戰。再生醫療業者可採取多元化策略,包括與技術領先者合作進行產品研發與技術轉移,運用現代化的調整性臨床試驗設計加速產品的開發過程,並通過了解與利用細胞療法的加速上市法規政策,達成搶占市場商機目標。...